解析氨基酸的性质
 2018-11-06 13:20:50
2018-11-06 13:20:50
无色晶体,熔点极高,一般在200℃以上。不同的氨基酸其味不同,有的无味,有的味甜,有的味苦,谷氨酸的单钠盐有鲜味,是味精的主要成分。各种氨基酸在水中的溶解度差别很大,并能溶解于稀酸或稀碱中,但不能溶于有机溶剂。通常酒精能把氨基酸从其溶液中沉淀析出。
紫外吸收性质
氨基酸的一个重要光学性质是对光有吸收作用。
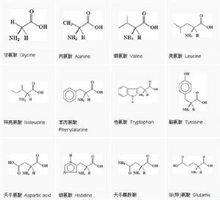
20种Pr——AA在可见光区域均无光吸收,在远紫外区(<220nm)均有光吸收,在紫外区(近紫外区)(220nm—300nm)只有三种AA有光吸收能力,这三种氨基酸是苯丙氨酸、酪氨酸、色氨酸,因为它们的R基含有苯环共轭双键系统。苯丙AA最大光吸收在259nm、酪AA在278nm、色AA在279nm,蛋白质一般都含有这三种AA残基,所以其最大光吸收在大约280nm波长处,因此能利用分光光度法很方便的测定蛋白质的含量。分光光度法测定蛋白质含量的依据是朗伯—比尔定律。在280nm处蛋白质溶液吸光值与其浓度成正比。
酸碱性质
1、两性解离与等电点
氨基酸在水溶液或结晶内基本上均以兼性离子或偶极离子的形式存在。所谓两性离子是指在同一个氨基酸分子上带有能释放出质子的NH3正 缬氨酸离子和能接受质子的COO-负离子,因此氨基酸是两性电解质。
氨基酸的等电点:氨基酸的带电状况取决于所处环境的PH值,改变PH值可以使氨基酸带正电荷或负电荷,也可使它处于正负电荷数相等,即净电荷为零的两性离子状态。使氨基酸所带正负电荷数相等即净电荷为零时的溶液PH值称为该AA
2、解离常数
解离式中K1和K2′分别代表α-碳原子上-COOH和-NH3的表现解离常数。在生化上,解离常数是在特定条件下(一定溶液浓度和离子强度)测定的。等电点的计算可由其分子上解离基团的表观解离常数来确定。
氨基酸解离常数列表:
缩写 中文译名 支链 分子量 等电点 羧基解离常数 氨基解离常数 Pkr(R) R基
Gly G 甘氨酸 亲水性 75.07 6.06 2.35 9.78 -H
Ala A 丙氨酸 疏水性 89.09 6.11 2.35 9.87 -CH3
Val V 缬氨酸 疏水性 117.15 6.00 2.39 9.74 -CH-(CH3)2
Leu L 亮氨酸 疏水性 131.17 6.01 2.33 9.74 -CH2-CH(CH3)2
Ile I 异亮氨酸 疏水性 131.17 6.05 2.32 9.76 -CH(CH3)-CH2-CH3
Phe F 苯丙氨酸 疏水性 165.19 5.49 2.20 9.31 -CH2-C6H5
Trp W 色氨酸 疏水性 204.23 5.89 2.46 9.41 -C8NH6
Tyr Y 酪氨酸 疏水性 181.19 5.64 2.20 9.21 10.46 -CH2-C6H4-OH
Asp D 天冬氨酸 酸性 133.10 2.85 1.99 9.90 3.90 -CH2-COOH
Asn N 天冬酰胺 亲水性 132.12 5.41 2.14 8.72 -CH2-CONH2
Glu E 谷氨酸 酸性 147.13 3.15 2.10 9.47 4.07 -(CH2)2-COOH
Lys K 赖氨酸 碱性 146.19 9. 60 2.16 9.06 10.54 -(CH2)4-NH2
Gln Q 谷氨酰胺 亲水性 146.15 5.65 2.17 9.13 -(CH2)2-CONH2
Met M 甲硫氨酸 疏水性 149.21 5.74 2.13 9.28 -(CH2)-S-CH3
Ser S 丝氨酸 亲水性 105.09 5.68 2.19 9.21 -CH2-OH
Thr T 苏氨酸 亲水性 119.12 5.60 2.09 9.10 -CH(CH3)-OH
Cys C 半胱氨酸 亲水性 121.16 5.05 1.92 10.70 8.37 -CH2-SH
Pro P 脯氨酸 疏水性 115.13 6.30 1.95 10.64 -C3H6
His H 组氨酸 碱性 155.16 7.60 1.80 9.33 6.04
Arg R 精氨酸 碱性 174.20 10.76 1.82 8.99 12.48
3、多氨基(碱性氨基酸)和多羧基(酸性氨基酸)氨基酸的解离
解离原则:先解离α-COOH,随后其他-COOH;然后解离α-NH3+,随后其他-NH3。总之羧基解离度大于氨基,α-C上基团大于非α-C上同一基团的解离度。等电点的计算:首先写出解离方程,两性离子左右两端的表观解离常数的对数的算术平均值。一般PI值等于两个相近PK值之和的一半。如天冬氨酸 赖氨酸。
4、氨基酸的酸碱滴定曲线
以甘氨酸为例:摩尔甘氨酸溶于水时,溶液PH为5.97,分别用标准NaOH和HCL滴定,以溶液PH值为纵坐标,加入HCL和NaOH的摩尔数为横坐标作图,得到滴定曲线。该曲线一个十分重要的特点就是在PH=2.34和PH=9.60处有两个拐点,分别为其PK1和PK2。 规律:pH


 当前位置:
当前位置: